本学部、食品生命情報科学研究室(中野祥吾研究室)と共同で、タンパク質を効率的に修飾できる酵素を開発、ACS Catalysis誌で発表しました。特許出願済であり、技術導出先も探しています。
- 祖先配列再構成法を用いて、高機能なタンパク質連結酵素 (AcSE5; 祖先型ソルターゼE) の開発に成功しました。
- AcSE5は、高い連結活性に加え、様々な求核剤 (トリグリシン、アルキルアミン) を基質にできることが特徴です。
- AcSE5を用いて、蛍光タンパク質を含む、機能的なタンパク質を、効率的に抗体に連結することに成功しました (修飾抗体)。
- AcSE5を用いて、固定化担体に効率的に酵素を連結することに成功しました (固定化酵素)。固定化された酵素は、長期間高い活性を保持していることを確認しました。
- AcSE5は、タンパク質や酵素に、様々なタンパク質、酵素、化合物を、穏やかな反応条件下で連結することができます。今後、次世代のバイオ医薬品 (抗体など)、タンパク質・酵素の産業利用の加速が期待できます。
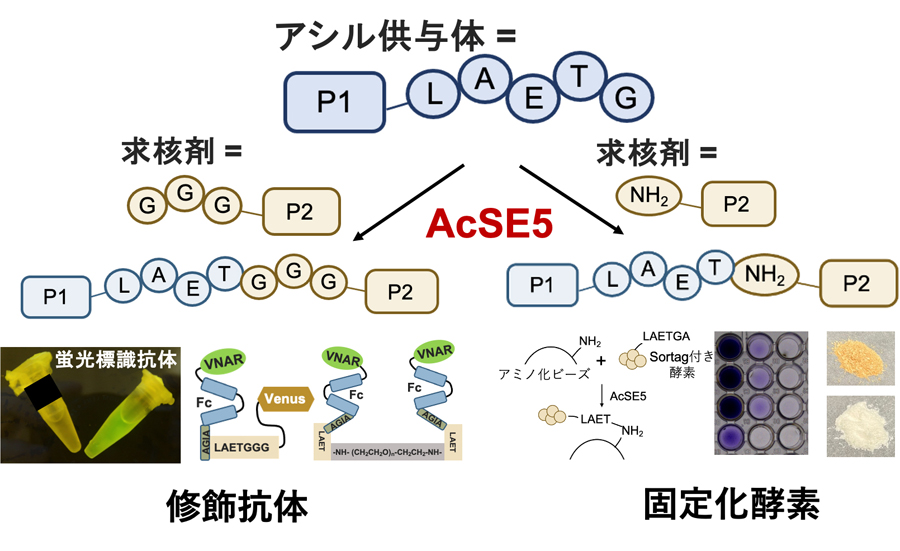
図: 高機能化祖先型ソルターゼE (AcSE5) の概要。AsSE5は、アシル供与体(タンパク質)に、様々な求核剤(タンパク質を含む多様な化合物)を連結できるのが特徴。図のように、抗体を蛍光タンパク質で修飾したり、酵素を固定化したりすることができる。
(出願番号) 特願2023-066172
(発明の名称) ペプチドライゲーション活性を有するポリペプチド及びその利用
